作者:汪东浩、陈飞飞
近日,beat365官网beat365体育官网平台生物反应器工程国家重点实验室、上海生物制造产业省部共建协同创新中心许建和教授和郑高伟教授团队,在胺脱氢酶的功能拓展方面研究取得新进展。美国化学会催化杂志ACS Catalysis以“Asymmetric Reductive Amination of Structurally Diverse Ketones with Ammonia Using a Spectrum-Extended Amine Dehydrogenase”为题报道了这一研究成果(ACS Catal. 2021, 11, 14274-14283)。
胺脱氢酶催化的不对称还原胺化因所利用的氨基供体为廉价的无机氨,且形成的副产物只有水,被认为是手性胺绿色合成的最有前景途径。该类酶自2012年首次报道以来,引发了广泛的关注。近年来,许建和教授和郑高伟教授在胺脱氢酶的研究中不断取得突破,例如利用蛋白质工程改造技术开发了多种新型的胺脱氢酶(ACS Catal. 2018, 8, 2622-2628; Catal. Sci. Technol. 2020, 10, 2353-2358),并且基于胺脱氢酶构建了绿色高效的多酶级联反应,巧妙解决外消旋醇不对称转化为光学纯手性胺的难题(ChemCatChem 2015, 7, 3838–3841; J. Org. Chem. 2019, 84, 14987−14993)。
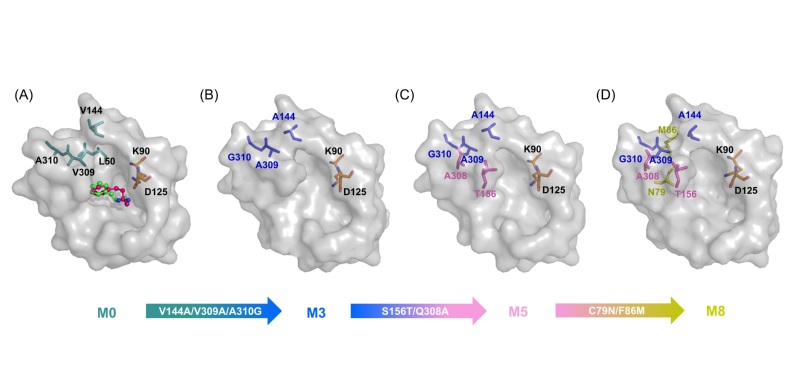
图片说明:胺脱氢酶底物结合口袋的重塑
然而这类酶目前仍存在底物谱窄的问题,极大地限制了它们在光学纯手性胺合成中的应用。该课题组通过对酶与底物的构效关系分析,采用计算机辅助的蛋白质工程技术,确定了酶活性口袋中影响酶与大位阻底物结合的关键残基(Val144、Val309和Ala310),通过理性设计将其突变成侧链位阻较小的丙氨酸与甘氨酸,实现了酶底物活性口袋“容积”的拓展,使其对多种大位阻底物表现出“从无到有”的催化活性,极大地拓宽了该酶的催化底物范围。进而,通过筛选更多有益突变位点实现了该酶的进一步“人工进化”,酶活力相较于野生酶提升110倍,并且基于该突变酶实现了大位阻手性药物中间体的制备。此外,基于酶分子动力学模拟,研究者通过结合能、残基相互作用、基团间距离变化等因素分析,对该酶改造过程中的催化活性与稳定性的提升进行了机理阐述,为该类酶的后续改造与应用研究奠定了良好的基础。
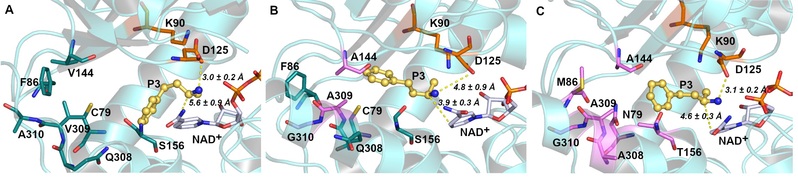
图片说明:胺脱氢酶分子改造过程中催化性能提升的分子机制
该工作得到了国家重点研发计划“合成生物学”专项(2019YFA0905000)、国家自然科学基金重点项目和面上基金等项目的资助。硕士研究生汪东浩和殷赛男作为论文共同第一作者,主要完成了酶分子改造和底物谱研究,陈琦副教授主要完成了酶分子动力学模拟研究,论文通讯作者分别为陈飞飞博士、许建和教授和郑高伟教授。