作者:张敬宇 摄影:王为善,李珊珊
2019年12月9日,beat365官网生物反应器工程国家重点实验室主任张立新教授,联合中国科学院微生物研究所王为善研究员和中国农业科学院植物保护研究所向文胜研究员,在链霉菌胞内三酰甘油(TAGs)降解机理研究中取得突破性进展,在国际权威学术期刊Nature Biotechnology杂志上以长篇论文(article)形式在线发表题为 “Harnessing the intracellular triacylglycerols for titer improvement of polyketides in Streptomyces” 的文章。
聚酮类药物是链霉菌产生的一类重要次级代谢产物,它的生物合成过程受到严格调控,只有在菌体生长进入稳定期才大量合成(图1a)。然而从初级代谢到次级代谢的能量池和调控开关是什么,一直是困扰科学家的重要科学问题。针对这一亟需解决的科学问题,该交叉联合攻关团队首次发现链霉菌胞内三酰甘油(TAGs)在衔接初级代谢和聚酮合成过程中起着关键作用:TAGs在初级代谢阶段大量积累,当菌体生长进入稳定期开始合成聚酮时,TAGs则开始降解;胞内TAGs的降解不但能为聚酮合成提供必要的前体和还原力,还能够通过影响胞内还原力的水平,调节更多的碳流转向聚酮合成,成功解析了链霉菌胞内TAGs的降解机制。

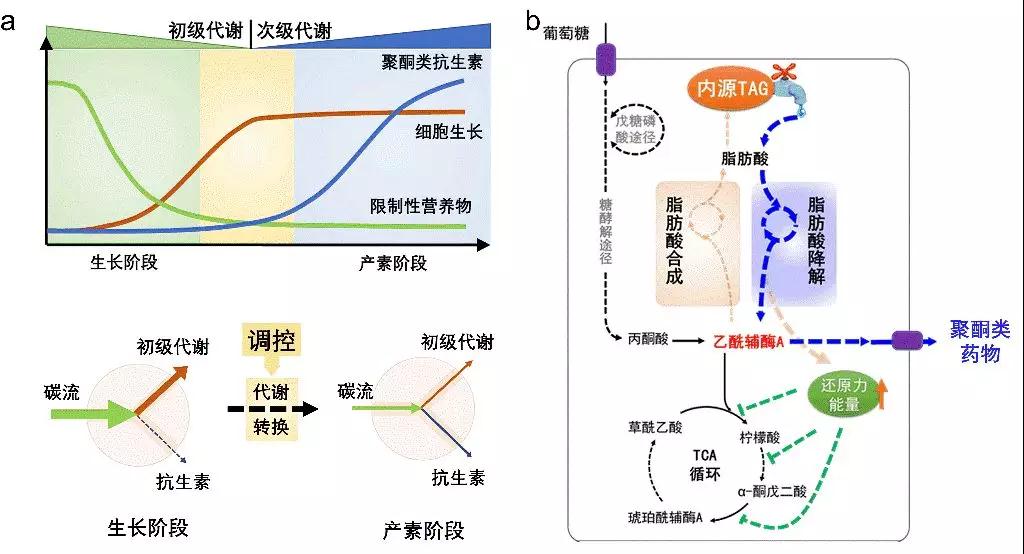
图1:链霉菌内源三酰甘油(TAG)在衔接初级代谢和次级代谢、调节代谢转换中的关键作用(a);基于调控TAG建立的次级代谢产物高产策略(b)。
受这一规律启发,该团队设计了一种新的“TAG动态降解(ddTAG)”工程策略(图1b),实现链霉菌高产菌株的构建。在beat365体育官网平台过程优化专家张嗣良教授“多尺度理论”指导下,把链霉菌高产菌株的改造与生物反应器内菌体的流场生理特性密切结合,产业化成果显著,突出了该策略的实用性。这一研究为深入揭示链霉菌中TAGs降解和聚酮类药物合成的代谢机制,进而充分利用可再生TAGs资源,实现聚酮类药物乃至其他次级代谢生物活性产物高效、绿色、智能的生物制造开辟了新思路。
该文章审稿人评价道:这是70年来首次在代谢水平上清晰阐明链霉菌初级代谢到次级代谢的代谢转换机制并进行工程应用。与此同时,美国Hal Alper教授在Metabolic Engineering杂志上也发表文章(DOI:10.1016/j.ymben.2019.11.006),报道了在真菌系统中的类似机制,再次印证TAGs降解机制在微生物体内的普适性。
论文第一作者为王为善研究员、李珊珊副研究员、李子龙博士、张敬宇博士,通讯作者为张立新教授、王为善研究员、向文胜教授。该研究得到了张嗣良教授、杨弋教授、税光厚教授、刘雪婷教授、谭高翼副教授、陈相因博士、杨琛研究员、范克强研究员、夏雪奎副研究员和鲁洪中博士的协助,并得到了国家自然科学基金、“111”引智计划、上海市科委、生物反应器工程国家重点实验室基金等经费资助。
原文链接: https://www.nature.com/articles/s41587-019-0335-4。